クリニカルシーケンス インタビュー⑨
がんゲノム医療を支えるデータサイエンス

埼玉県立がんセンター
腫瘍診断・予防科
赤木 究 先生
同じ臓器から発症したがんでも、個々のがんで遺伝子の変化が異なることが明らかになり、遺伝情報であるゲノムの検査結果を診断や治療に利用する「がんゲノム医療」に注目が集まっています。背景には、特定の分子を調節する分子標的薬や抗体医薬が続々と登場したことで、ゲノム情報がその選択のための重要なバイオマーカーとなるためです。しかしながら、臨床的にエビデンスのあるゲノム情報は全く不足しており、今後はゲノム情報、診療情報を収集・統合し、それらの情報を利活用することが望まれます。このようながんゲノム医療時代を迎えるにあたり、遺伝子の疫学的・機能的情報、データマイニング、患者の個人情報管理など、倫理的にも技術的にも多くの課題を解決していかなければなりません。アメリエフ株式会社の経営陣2人が、がんゲノム医療開発プロジェクトに携わる埼玉県立がんセンター腫瘍診断・予防科の赤木究博士と対談し、意見交換を行いました。
◆がんゲノム医療で必要な遺伝子情報とは?
山口:最初に、埼玉県立がんセンターにおけるがんゲノム医療の取り組みについての概略を伺えますか?
赤木:一言でいえば、ゲノム情報を治療戦略に生かすことです。はじめは肺がんや大腸がんの体細胞遺伝子変異のタイプから各種分子標的治療薬の効果予測をしていましたが、近年では、体細胞だけでなく生殖細胞系列の遺伝子変化から治療効果を予測するような分子標的治療薬も出現してまいりました。そのため現在では、体細胞レベルのみならず生殖細胞系列レベルの遺伝子変化も調べています。しかし個々でできることには限界があるので、調べた遺伝子の情報を社会で共有する取り組みも行っています。
例えば、最近注目されているがん免疫療法とも深くかかわる遺伝性腫瘍症候群の1つであるリンチ症候群に関しては、遺伝子解析データを多くの施設と協力して収集し、日本人のデータベース構築を試みております。こうしたデータベースが整備されることが、がん診療を円滑に進める上で大変重要になってきます。
また、最近承認されましたPARP阻害薬の適応判定には、遺伝性乳がん卵巣がん症候群の遺伝子診断を行うことになり、BRCA1/2遺伝子のバリアントに関する充実したデータベースが診療上必要です。こうしたことも含め、当施設におけるがんゲノム診療体制整備にも取り組んでおります。
三澤:アメリエフ社では、がんゲノム医療情報の収集・蓄積・利活用が重要と考え、情報の利活用にフォーカスした AmeliCure (アメリキュア) [図 1] を2015年より開発し、5箇所の医療機関に導入させていただきました。使用する遺伝子検査パネルも様々で、膨大な遺伝子情報が得られるため、医療機関によってニーズが多様です。
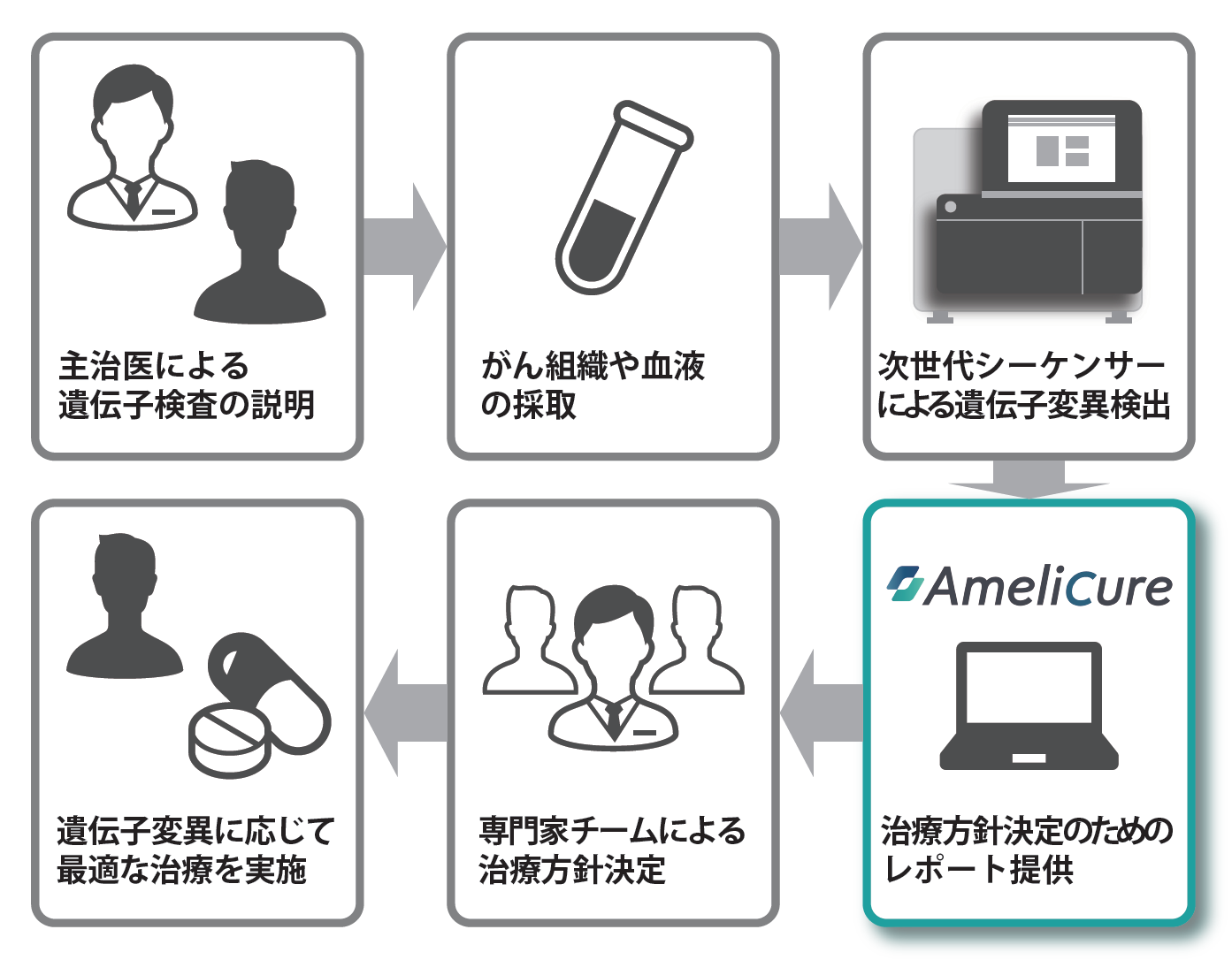
◆多様化する遺伝情報にどう対応するべき?
山口:高価にはなりますが、数百個の遺伝子を調べるパネル検査や全遺伝情報を調べる全ゲノム解析(以下WGS)でゲノム変異情報を調べるという手段もあると思うのですが、ご検討はされていますか?
赤木:確かに、次世代シーケンサーを使えば膨大な遺伝情報が得られますが、現在、実臨床で利用できる遺伝子は限られています。そのため、私たちは、量より質を大事にしています。調べる遺伝子の数が絞り込まれているため、レポートされているバリアントは合理的で正しいか、情報が足りているか、見落としがないかを直接自分たちの目で検証するようにしています。一度にたくさんの遺伝子をみると、見落としてしまうリスクが増えることをむしろ懸念しています。時間と費用対効果を考え、具体的には保険適応の薬剤を念頭に遺伝子数を絞り、後から知りたいゲノム情報が出てきた場合は、研究目的として追加で調べることを考えています。その際にはWGSもありうるかと思います。今はまだ、バリアントと薬の感受性・副作用との相関に関するエビデンスとなる知見を集めなくてはならない段階です。頻度の少ない遺伝子バリアントの情報を得るためには、世界規模で情報を蓄積し、共有をはかる必要があります。
山口:情報の集約という点では、やはり国が主導すべきとお考えですか?
赤木:診療に利用するわけですから、十分な情報量があり、継続性のあるしっかりとしたデータベースでなければいけませんので、国が主導すべきでしょう。現状では、国立がん 研究センター内に「がんゲノム情報管理センター」が開設 され、がんゲノム医療中核拠点病院を中心に情報共有が進められると聞いています。中核拠点や連携病院以外の医療機関においても、アノテーションやフォーマットの統一が重要だと思います。
山口:がんゲノム医療を推進するためには、DNAの配列情報だけでなく、RNAやタンパク質など多様な情報も必要になっていくのでしょうか。
赤木:はい、DNAレベルでは判定できない場合もあります。
ゲノム上のバリアントが発現やスプライシングにどう影響しているのかは、実際にRNAを調べないとわかりません。もちろんDNAの配列から予測することは可能ですが、診療に用いる情報ですので、可能な限り検証する必要があると思います。実際、私たちはエクソン内の1塩基置換がスプライシングの異常を起こしているケースを複数見出しており、これはRNAとDNAを同時に解析し、評価しない限り見つけることはできなかったと思われます。
山口:DNA と RNA の配列情報から高精度に遺伝子変異やスプライシング異常を予測・同定する解析パイプラインの開発は、2017年より共同研究で進めているテーマですね。
◆データサイエンスに求められることとは?

山口:がんゲノム医療を進め、新しい医療の形として発展させて行くにはどのような課題があると考えていらっしゃいますか?
赤木:今後、人工知能を用いた予測などを考えると、大量のゲノム情報を解析・収集することよりも、数は少なくても、より正確で詳細な質の高い情報を多く集めることに重きを置くべきではないかと考えます。従って、現段階では遺伝子パネル検査においても数よりも質の高さを求めるべきではないかと思います。また、解析にかかる費用を考えると、「本当に患者さんのためになっているのか」を考える必要がありますね。本当に使える情報を創出するために、情報解析を担当してくれる研究機関や受託会社などが医療機関と連携を取りやすい体制を整備すべきかと思います。
三澤:今後は、レポート機能だけでなく、データ蓄積と分析の機能を実装していきたいと考えています。AmeliCureでアノテーションされる情報は常に最新のデータベースを参照するようにしていますが、海外での症例に基づくデータベースが大半で、日本人のエビデンスとしては弱いのが現状です。医療機関ごとに過去のがん患者さんの情報が蓄積され、分析されることで日本人としてのがんゲノム医療情報や治療情報が蓄積され、より精度の高い診断や治療に結びつけることができればと考えています。
赤木:複雑化する情報を有機的に結びつけて患者さんのための医療を提供するためにも、いろいろな立場の専門家が 集まって議論する必要がありますし、情報共有のための全国的なコミュニティーを形成する必要があると思います。 そのような活動に対して、産官学の共同研究を国としても後押ししていただきたいですね。
山口:ありがとうございました。
インタビュー:2018年8月

